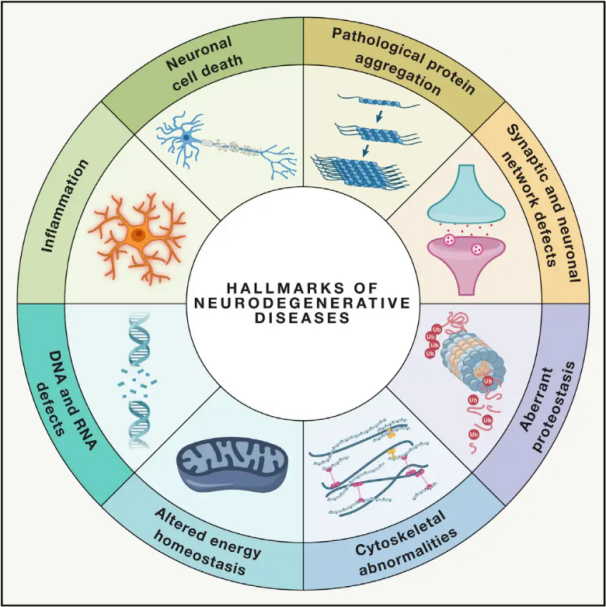
Neurodegenerativne bolesti(NDD) karakterizira progresivni ili trajni gubitak specifičnih ranjivih neuronskih populacija unutar mozga ili leđne moždine. Klasifikacija NDD-a može se temeljiti na različitim kriterijima, uključujući anatomsku distribuciju neurodegeneracije (kao što su ekstrapiramidalni poremećaji, frontotemporalna degeneracija ili spinocerebelarna ataksija), primarne molekularne abnormalnosti (poput amiloida-β, priona, tau ili α-sinukleina) ili glavne kliničke značajke (kao što su Parkinsonova bolest, amiotrofična lateralna skleroza i demencija). Unatoč tim razlikama u klasifikaciji i prezentaciji simptoma, poremećaji poput Parkinsonove bolesti (PB), amiotrofične lateralne skleroze (ALS) i Alzheimerove bolesti (AD) dijele zajedničke temeljne procese koji dovode do neuronske disfunkcije i na kraju stanične smrti.
S obzirom na to da milijuni ljudi diljem svijeta pogađaju neurodegenerativne poremećaje (NDD), Svjetska zdravstvena organizacija procjenjuje da će do 2040. godine ove bolesti postati drugi vodeći uzrok smrti u razvijenim zemljama. Iako postoje različiti tretmani dostupni za ublažavanje i upravljanje simptomima povezanim sa specifičnim bolestima, učinkovite metode za usporavanje ili liječenje napredovanja ovih stanja ostaju nedostižne. Nedavne studije ukazuju na pomak u paradigmama liječenja od pukog simptomatskog liječenja do korištenja mehanizama zaštite stanica kako bi se spriječilo daljnje pogoršanje. Opsežni dokazi upućuju na to da oksidativni stres i upala igraju ključnu ulogu u neurodegeneraciji, pozicionirajući te mehanizme kao kritične ciljeve za staničnu zaštitu. Posljednjih godina, temeljna i klinička istraživanja otkrila su potencijal hiperbarične oksigenoterapije (HBOT) u liječenju neurodegenerativnih bolesti.
Razumijevanje hiperbarične oksigenoterapije (HBOT)
HBOT obično uključuje povećanje tlaka iznad 1 apsolutne atmosfere (ATA) - tlaka na razini mora - u trajanju od 90-120 minuta, što često zahtijeva više sesija ovisno o specifičnom stanju koje se liječi. Povećani tlak zraka poboljšava dostavu kisika stanicama, što zauzvrat stimulira proliferaciju matičnih stanica i poboljšava procese ozdravljenja posredovane određenim faktorima rasta.
Izvorno, primjena HBOT-a temeljila se na Boyle-Marriottovom zakonu, koji pretpostavlja smanjenje mjehurića plina ovisno o tlaku, uz prednosti visoke razine kisika u tkivima. Postoji niz patologija za koje se zna da imaju koristi od hiperoksičnog stanja uzrokovanog HBOT-om, uključujući nekrotična tkiva, ozljede od zračenja, traume, opekline, sindrom odjeljka i plinsku gangrenu, među ostalima koje je navelo Podmorsko i hiperbarično medicinsko društvo. Značajno je da je HBOT također pokazao učinkovitost kao dodatni tretman u raznim modelima upalnih ili zaraznih bolesti, poput kolitisa i sepse. S obzirom na svoje protuupalne i oksidativne mehanizme, HBOT nudi značajan potencijal kao terapijski put za neurodegenerativne bolesti.
Predkliničke studije hiperbarične oksigenoterapije kod neurodegenerativnih bolesti: Uvidi iz 3×Tg mišjeg modela
Jedna od značajnih studijausredotočeno na 3×Tg mišji model Alzheimerove bolesti (AB), koji je pokazao terapijski potencijal HBOT-a u ublažavanju kognitivnih deficita. Istraživanje je uključivalo 17-mjesečne mužjake 3×Tg miševa u usporedbi s 14-mjesečnim mužjacima C57BL/6 miševa koji su služili kao kontrola. Studija je pokazala da HBOT ne samo da poboljšava kognitivnu funkciju, već i značajno smanjuje upalu, opterećenje plakom i fosforilaciju Tau proteina - ključni proces povezan s patologijom AB-a.
Zaštitni učinci HBOT-a pripisani su smanjenju neuroinflamacije. To je dokazano smanjenjem proliferacije mikroglije, astroglioze i lučenja proinflamatornih citokina. Ovi nalazi naglašavaju dvostruku ulogu HBOT-a u poboljšanju kognitivnih performansi, a istovremeno ublažavanju neuroinflamatornih procesa povezanih s Alzheimerovom bolešću.
Drugi predklinički model koristio je miševe s 1-metil-4-fenil-1,2,3,6-tetrahidropiridin (MPTP) za procjenu zaštitnih mehanizama HBOT-a na neuronsku funkciju i motoričke sposobnosti. Rezultati su pokazali da HBOT doprinosi poboljšanoj motoričkoj aktivnosti i snazi stiska kod ovih miševa, što je u korelaciji s povećanjem signalizacije mitohondrijske biogeneze, posebno putem aktivacije SIRT-1, PGC-1α i TFAM-a. To naglašava značajnu ulogu mitohondrijske funkcije u neuroprotektivnim učincima HBOT-a.
Mehanizmi HBOT-a kod neurodegenerativnih bolesti
Temeljni princip korištenja HBOT-a za neurodegenerativne poremećaje leži u odnosu između smanjene opskrbe kisikom i osjetljivosti na neurodegenerativne promjene. Hipoksijom inducirani faktor-1 (HIF-1) igra središnju ulogu kao transkripcijski faktor koji omogućuje staničnu prilagodbu niskoj parcijalnoj napetosti kisika i povezan je s raznim neurodegenerativnim poremećajima, uključujući Alzheimerovu bolest, Parkinsonovu bolest, Huntingtonovu bolest i ALS, što ga čini ključnom metom lijekova.
Budući da je dob značajan faktor rizika za više neurodegenerativnih poremećaja, istraživanje utjecaja HBOT-a na neurobiologiju starenja je od vitalnog značaja. Studije su pokazale da HBOT može poboljšati kognitivne deficite povezane sa starenjem kod zdravih starijih osoba.Osim toga, stariji pacijenti sa značajnim oštećenjima pamćenja pokazali su kognitivna poboljšanja i povećan protok krvi u mozgu nakon izlaganja HBOT-u.
1. Utjecaj HBOT-a na upalu i oksidativni stres
HBOT je pokazao sposobnost ublažavanja neuroinflamacije kod pacijenata s teškom disfunkcijom mozga. Posjeduje sposobnost smanjenja proinflamatornih citokina (kao što su IL-1β, IL-12, TNFα i IFNγ), a istovremeno pojačava protuinflamatorne citokine (poput IL-10). Neki istraživači pretpostavljaju da reaktivne vrste kisika (ROS) koje generira HBOT posreduju u nekoliko korisnih učinaka terapije. Slijedom toga, osim djelovanja smanjenja mjehurića ovisnog o tlaku i postizanja visoke zasićenosti tkiva kisikom, pozitivni ishodi povezani s HBOT-om djelomično ovise o fiziološkim ulogama proizvedenih ROS-a.
2. Učinci HBOT-a na apoptozu i neuroprotekciju
Istraživanja su pokazala da HBOT može smanjiti fosforilaciju mitogenom aktivirane proteinske kinaze (MAPK) p38 u hipokampusu, što posljedično poboljšava kognitivne funkcije i smanjuje oštećenje hipokampusa. Utvrđeno je da i samostalna HBOT i u kombinaciji s ekstraktom ginka bilobe smanjuju ekspresiju Baxa i aktivnost kaspaze-9/3, što rezultira smanjenom stopom apoptoze kod glodavaca inducirane aβ25-35. Nadalje, druga studija pokazala je da prekondicioniranje HBOT-om inducira toleranciju na cerebralnu ishemiju, s mehanizmima koji uključuju povećanu ekspresiju SIRT1, uz povećane razine B-staničnog limfoma 2 (Bcl-2) i smanjenu aktivnu kaspazu-3, što naglašava neuroprotektivna i antiapoptotička svojstva HBOT-a.
3. Utjecaj HBOT-a na cirkulaciju iNeurogeneza
Izlaganje ispitanika HBOT-u povezano je s višestrukim učincima na kranijalni vaskularni sustav, uključujući povećanje propusnosti krvno-moždane barijere, poticanje angiogeneze i smanjenje edema. Osim što osigurava povećanu opskrbu tkiva kisikom, HBOTpotiče stvaranje krvnih žilaaktiviranjem transkripcijskih faktora poput faktora rasta vaskularnog endotela i stimuliranjem proliferacije živčanih matičnih stanica.
4. Epigenetski učinci HBOT-a
Studije su otkrile da izloženost ljudskih mikrovaskularnih endotelnih stanica (HMEC-1) hiperbaričnom kisiku značajno regulira 8101 gena, uključujući i pojačanu i smanjenu ekspresiju, što ističe povećanje ekspresije gena povezano s putovima antioksidativnog odgovora.
Zaključak
Upotreba HBOT-a s vremenom je značajno napredovala, dokazujući njegovu dostupnost, pouzdanost i sigurnost u kliničkoj praksi. Iako je HBOT istraživan kao izvanpropisni tretman za NDD-ove i provedena su neka istraživanja, i dalje postoji hitna potreba za rigoroznim studijama za standardizaciju HBOT praksi u liječenju ovih stanja. Daljnja istraživanja su neophodna kako bi se odredila optimalna učestalost liječenja i procijenio opseg korisnih učinaka za pacijente.
Ukratko, presjek hiperbarične oksigenacije i neurodegenerativnih bolesti pokazuje obećavajuću granicu u terapijskim mogućnostima, što opravdava kontinuirano istraživanje i validaciju u kliničkim uvjetima.
Vrijeme objave: 16. svibnja 2025.

